微信公众号: 回映电子
功能性消化不良(Functional Dyspepsia, FD)是临床最常见的功能性胃肠病之一,其核心症状包括餐后饱胀、早饱和上腹痛,严重影响患者生活质量。近年研究逐步揭示了其与迷走神经调控失衡的强关联性,迷走神经通过脑干孤束核(Nucleus Tractus Solitarius, NTS)与迷走神经背核(Dorsal Motor Nucleus of the Vagus, DMV)形成的迷走-迷走反射,直接调控胃动力、内脏感知及炎症反应。FD患者常表现为迷走神经张力降低,导致胃排空延迟、十二指肠低度炎症及TRPV1介导的内脏超敏。
非侵入性经皮耳迷走神经刺激(taVNS)通过激活耳部迷走神经分支,直接作用于NTS-DMV环路,动物实验证实其可同步改善胃动力障碍、内脏超敏及炎症反应,疗效与侵入性VNS相当。这一发现为FD的临床转化提供了兼具安全性与靶向性的新策略。
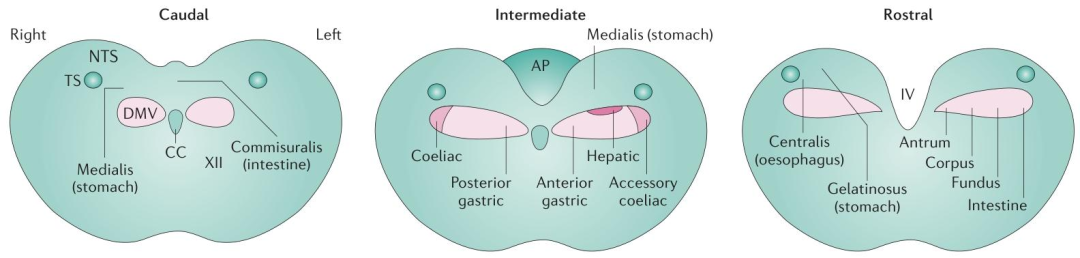
孤束核和迷走神经背运动核的解剖结构
HUIYING
功能性消化不良的神经生理基础
胃动力障碍与内脏超敏反应
FD的核心病理特征包括胃动力障碍和内脏超敏反应。胃动力障碍主要表现为胃排空延迟和胃适应性舒张功能减退,导致餐后胃窦蠕动减少,食物滞留于胃内。内脏超敏反应则表现为胃肠道对机械和化学刺激的敏感性增加,这与瞬时受体电位香草酸亚型1(TRPV1)在胃黏膜中的上调密切相关。TRPV1是一种与痛觉传导相关的离子通道,其过度表达直接加剧了FD患者的腹痛症状。
消化道内脏痛觉感受的潜在机制
十二指肠炎症与免疫失调
十二指肠低度炎症是FD的另一重要病理机制。嗜酸性粒细胞和肥大细胞浸润导致促炎细胞因子(如IL-6、IL-1β、TNF-α)释放,破坏十二指肠屏障功能,增加黏膜通透性,引发免疫反应。这种炎症状态进一步通过神经-免疫交互作用影响迷走神经信号传导,加剧胃动力障碍)。
迷走神经调控胃肠功能的核心作用
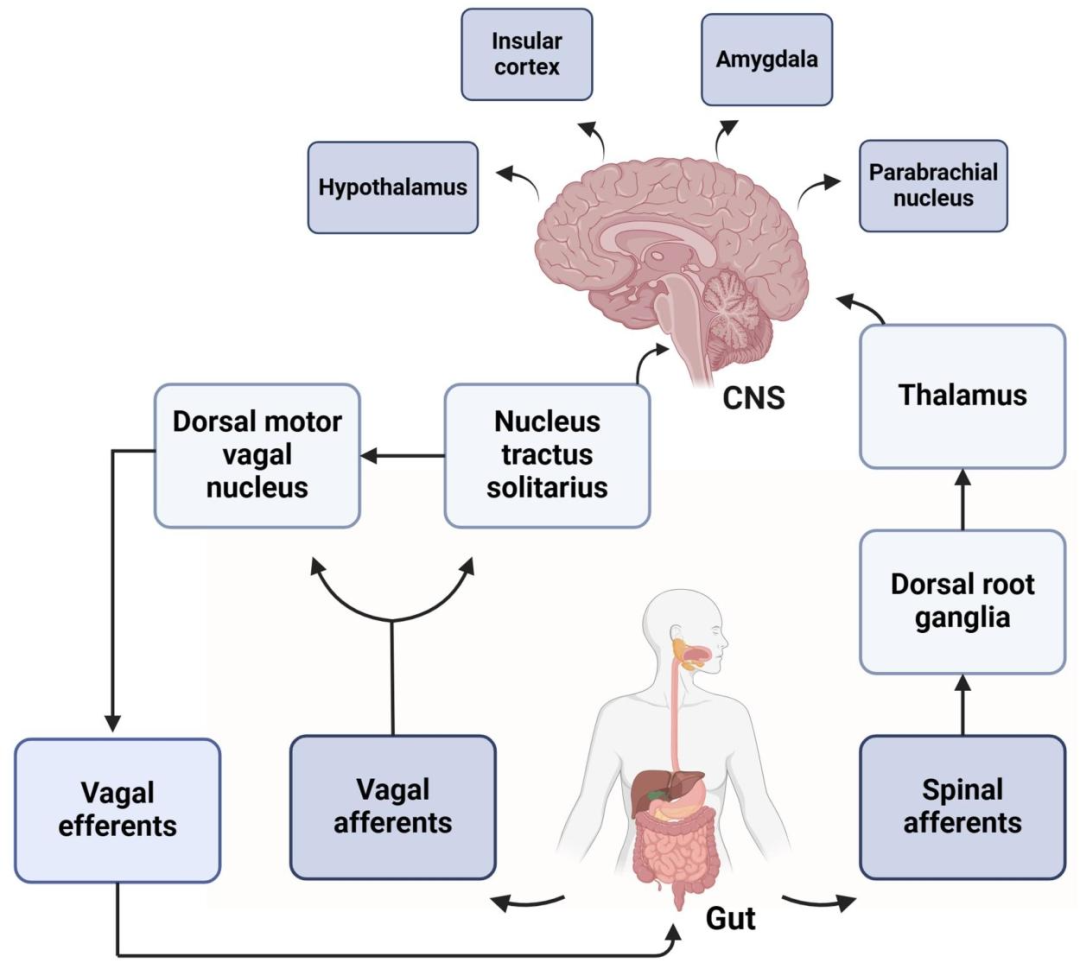
迷走神经是连接中枢神经系统与胃肠道的核心通路。其传入纤维将内脏感觉信号传递至孤束核NTS,NTS整合信息后通过迷走神经背核调控胃动力。迷走神经的传出纤维通过胆碱能通路(Cholinergic Anti-inflammatory Pathway, CAP)调节胃肠平滑肌收缩和分泌功能,同时通过胆碱能抗炎通路抑制炎症反应。FD患者的迷走神经张力降低,导致上述调控功能失衡,加剧症状。
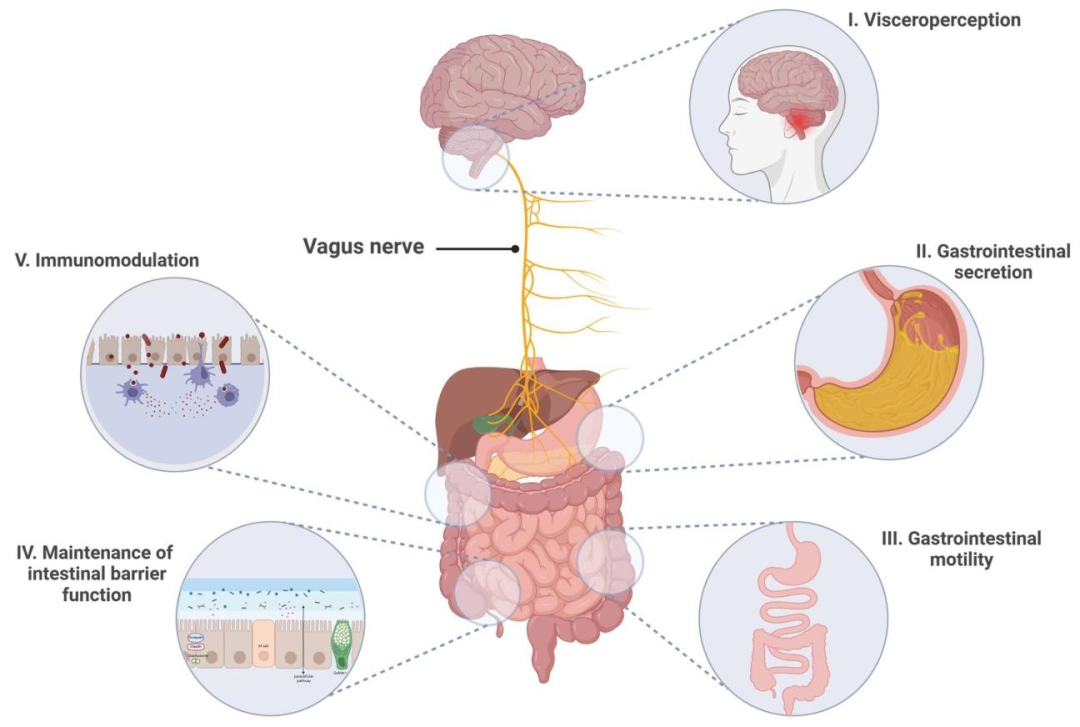
迷走神经在胃肠道中的作用
HUIYING
经皮耳迷走神经刺激(taVNS)的治疗机制
激活迷走神经通路
taVNS通过刺激耳部迷走神经分支激活迷走神经通路。耳部迷走神经分支直接投射至NTS,进而激活DMV,形成迷走-迷走反射。这一过程无需侵入性手术,避免了传统膈下迷走神经刺激(SDVNS)的感染和心动过缓风险。
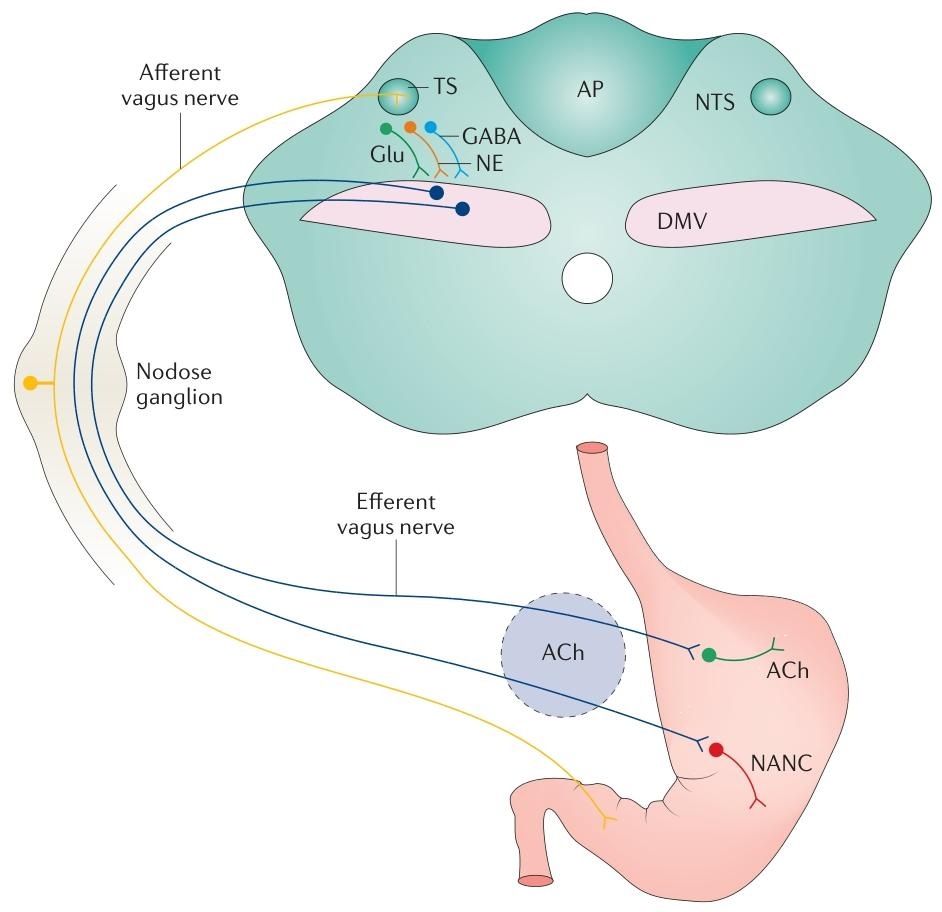
迷走- 迷走反射构成的脑干神经回路
胆碱能抗炎通路(CAP)的激活
taVNS通过增加乙酰胆碱(ACh)释放,激活α7烟碱型乙酰胆碱受体(α7nAChR),抑制NF-κB信号通路,减少促炎细胞因子(IL-6、IL-1β、TNF-α)的释放。动物实验显示,taVNS显著降低FD模型大鼠十二指肠中NF-κB p65水平,同时上调α7nAChR表达。
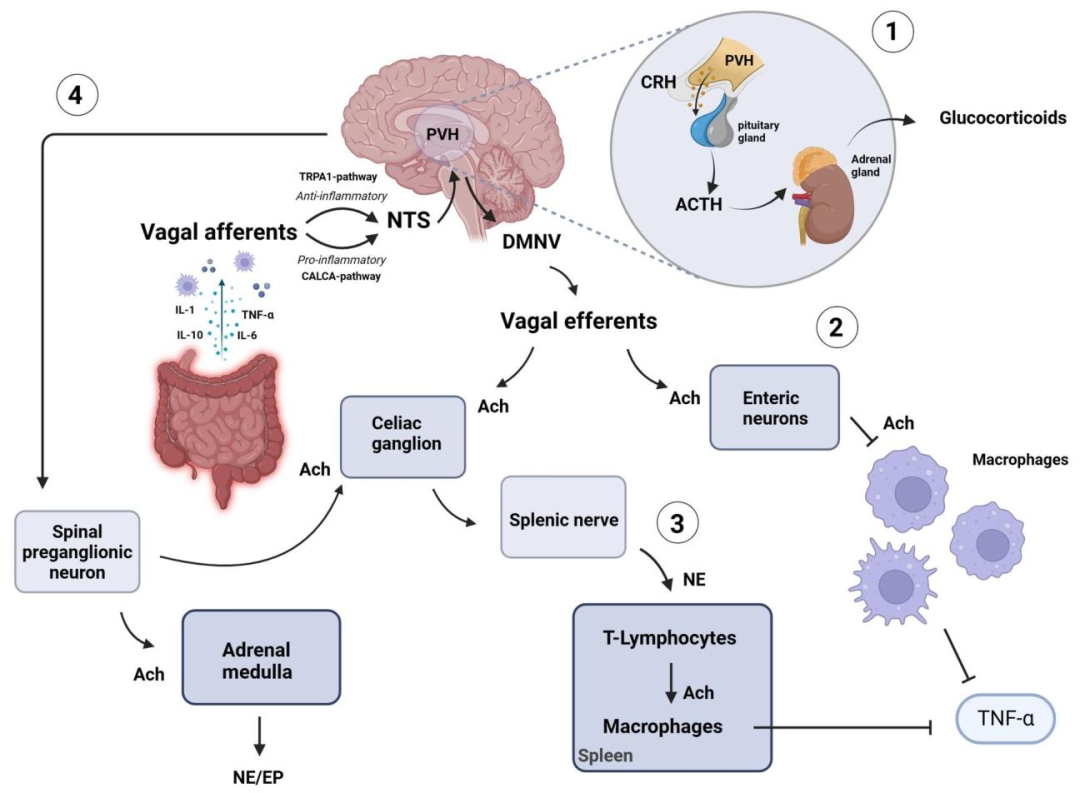
迷走神经的抗炎特性
(1)通过迷走神经传入纤维激活下丘脑 - 垂体 - 肾上腺轴;
(2)激活胆碱能抗炎通路;
(3)通过迷走神经传出纤维的非神经元胆碱能通路;
(4)激活迷走神经传入通路,包括瞬时受体电位锚蛋白 1(TRPA1)通路(抗炎信号)和降钙素基因相关肽 α(CALCA)通路(促炎信号)
胃动力与内脏敏感性的双重调节
taVNS通过以下机制改善胃动力
胃排空加速:增加十二指肠胃动素(Motilin, MTL)水平,促进胃窦收缩。
内脏镇痛:下调胃黏膜TRPV1表达,降低胃扩张诱发的肌电反应。
动物实验表明,taVNS组大鼠的胃排空率较对照组提高,且对40-80 mmHg胃扩张刺激的肌电反应显著减弱。
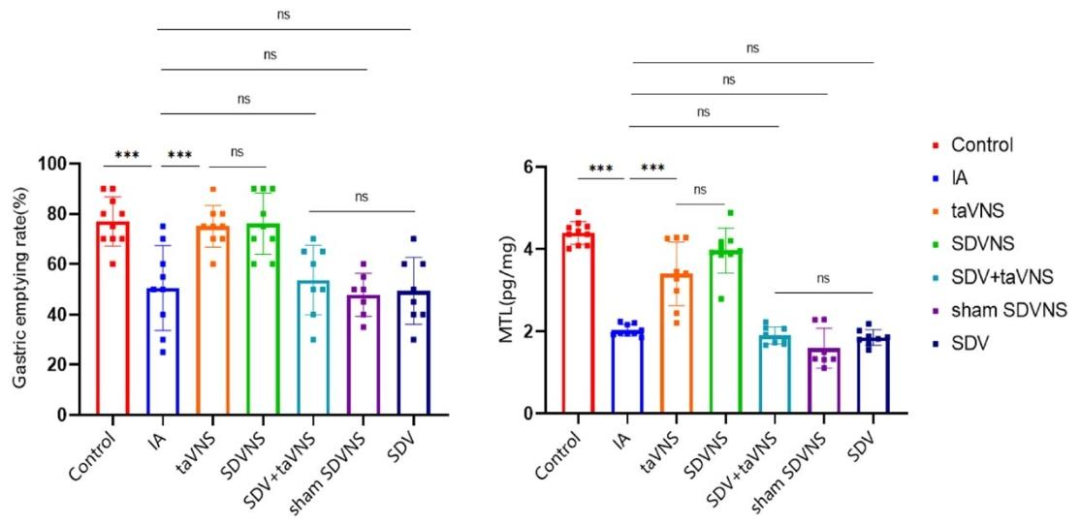
taVNS对胃排空率和MTL水平的影响
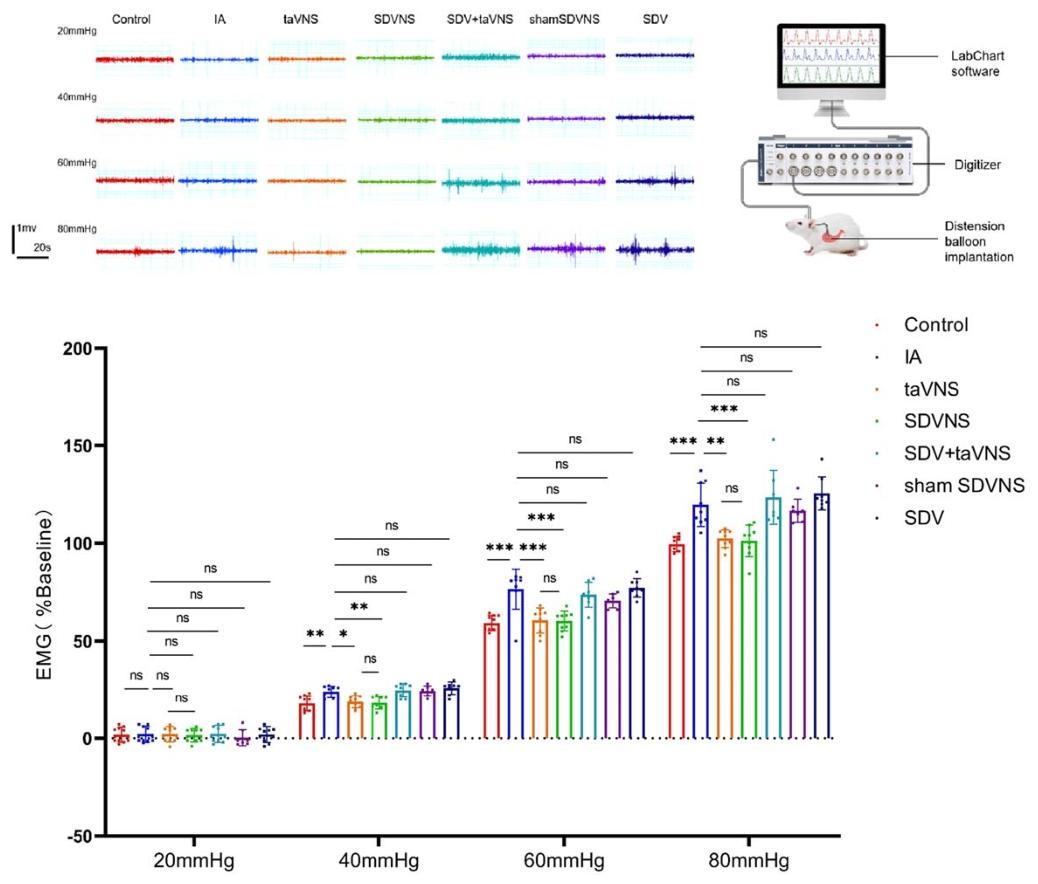
对20、40、60 和 80 毫米汞柱胃扩张产生反应的肌电图(EMG)波形变化
HUIYING
临床研究验证
研究方法
研究纳入36例符合罗马IV标准(功能性胃肠病诊断的重要标准)的FD患者,随机分为taVNS组(n=18)与假刺激组(sham-ES,n=18),采用双盲设计。干预方案如下:
急性实验:单次taVNS或假刺激(耳甲腔vs.前臂非迷走神经分布区),同步评估胃适应性(最大耐受饮水量,MTV)、胃慢波(体表胃电图EGG)及自主神经功能(心率变异性HRV分析)。
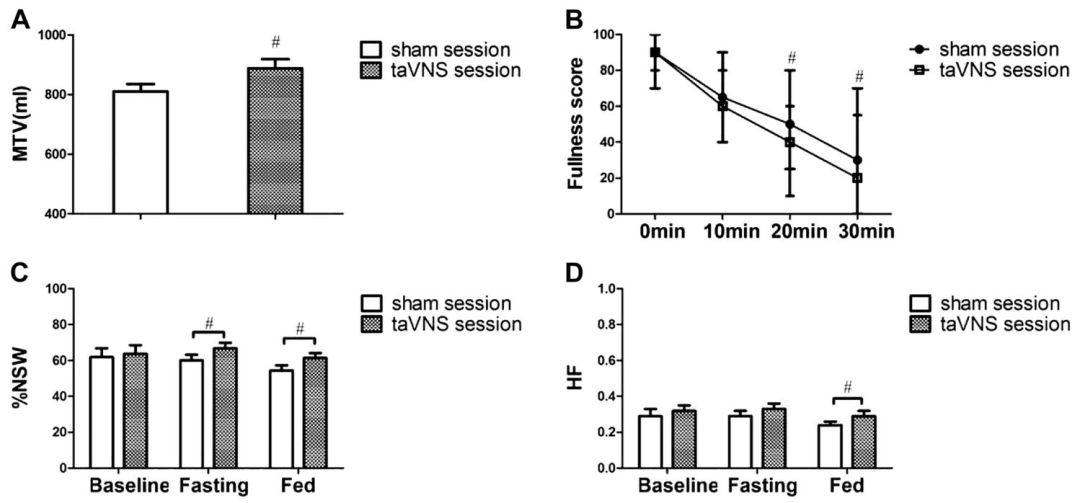
急性经皮耳迷走神经刺激(taVNS)的作用及自主神经机制
A:摄入最大量营养饮料后的胃容纳功能。B:摄入最大量营养饮料后的饱腹感评分。C:在假电刺激(sham-ES)和 taVNS 期间,基线、空腹(taVNS 和 sham-ES 过程中)以及进食(饮用营养饮料后)状态下,胃电图(EGG)四个通道平均的正常胃慢波百分比(% NSW)。D:taVNS 对迷走神经传出活动的影响。
慢性实验:每日2次、每次30分钟的taVNS治疗,持续2周,对比治疗前后消化不良症状量表(DSS)、焦虑抑郁评分(HADS)及胃功能指标变化。
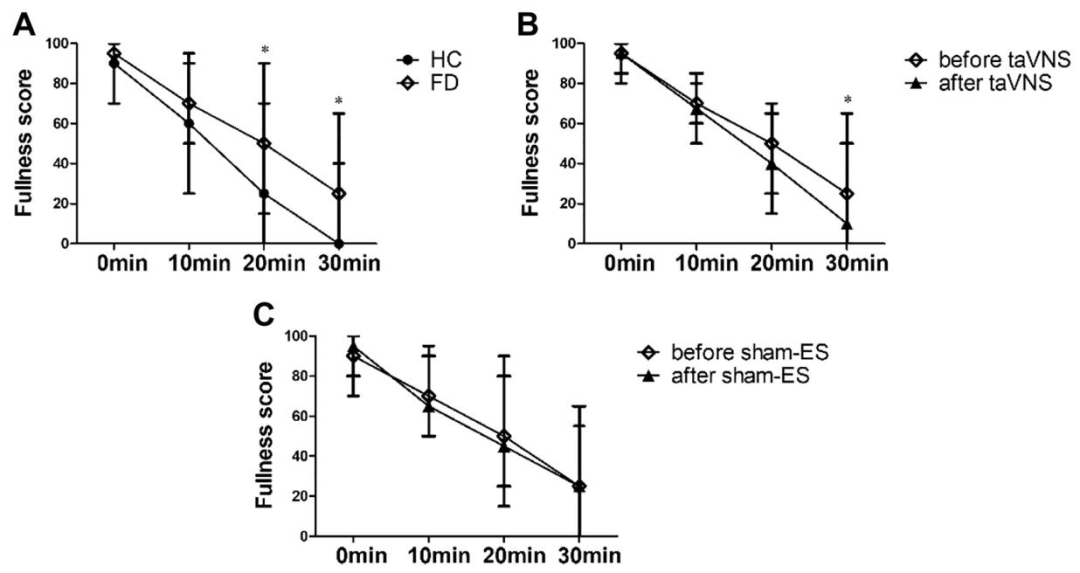
慢性经皮耳迷走神经刺激(taVNS)对胃容纳功能的影响
对照设计:同时纳入39例健康受试者(HC)作为基线对照。
研究结果
1.胃功能改善
胃适应性增强:急性taVNS显著提高MTV;慢性治疗2周后,taVNS组MTV恢复至健康水平,而假刺激组无改善。
胃慢波正常化:taVNS组空腹与餐后正常胃慢波百分比(%NSW)显著增加(空腹:66.8%→76.3%,P<0.05;餐后:61.3%→66.1%,P<0.05),且与迷走神经活动(HF)呈正相关(r=0.227)。
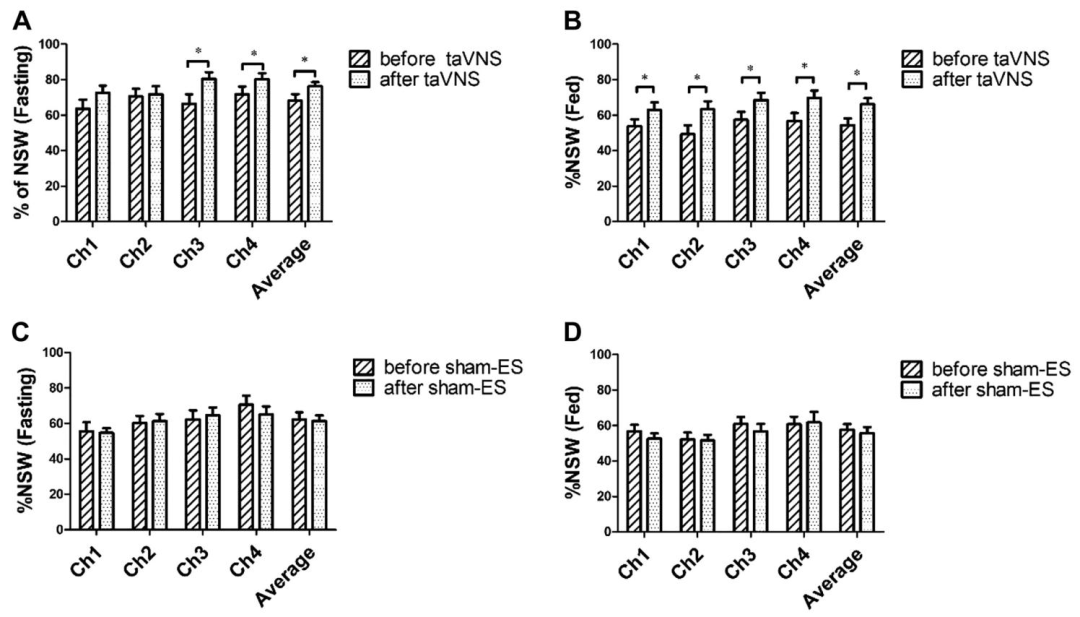
慢性经皮耳迷走神经刺激(taVNS)对正常胃慢波百分比(% NSW)的影响
2.症状缓解
消化不良症状:慢性taVNS显著降低DSS(消化不良症状量表)总分,尤其是腹胀与腹痛。
餐后饱胀评分:治疗后30分钟饱胀评分从25分降至10分,假刺激组无变化。
心理状态改善:焦虑与抑郁评分显著下降,且与DSS呈弱正相关(焦虑r=0.433,抑郁r=0.269)。
3.自主神经机制
迷走神经活动(HF)在taVNS组显著增强(空腹:0.32→0.42,P=0.015;餐后:0.28→0.35,P=0.048),交感迷走平衡(LF/HF)下降,证实taVNS通过增强迷走神经传出活动改善胃功能。
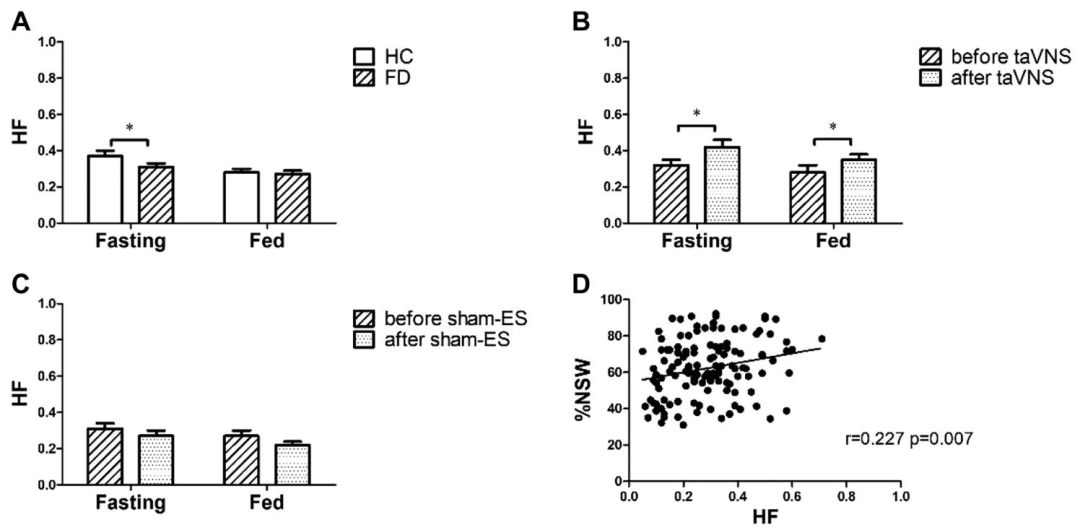
慢性经皮耳迷走神经刺激(taVNS)涉及自主神经功能的机制效应
安全性评估与总结
仅1例患者报告轻度耳鸣与失眠,无严重不良反应(如心动过缓或皮肤刺激)。假刺激组无显著疗效,进一步验证taVNS的特异性作用。临床研究证实,taVNS通过增强迷走神经活性,同步改善FD患者的胃动力障碍、内脏感知异常及心理症状,其非侵入性与安全性为临床提供了创新治疗选择。未来需扩大样本量并探索长期疗效,以优化个体化治疗方案。
HUIYING
taVNS的具体治疗参数
靶点区域:双侧耳甲艇(cymba concha),此为迷走神经耳支的主要分布区域(唯一可经皮刺激的迷走神经分支)。
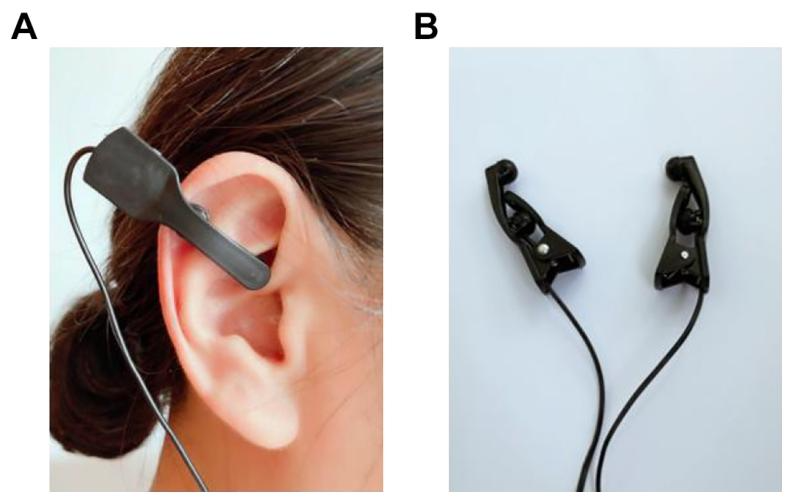
碳制电极夹置于双耳耳甲艇处
电刺激参数 | |
频率 | 25 Hz(部分研究对比10 Hz与25 Hz,两者疗效无显著差异,常用频率25 Hz) |
脉冲宽度 | 0.5 ms |
电流强度 | 0.5 mA至1.5 mA(根据患者耐受性调整) |
刺激模式 | 周期性刺激,每周期2秒开启(on-time),3秒关闭(off-time) |
波形 | 矩形脉冲波,双相信号 |
治疗周期与频率 | |
单次时长 | - 急性实验:30分钟单次刺激 |
总疗程 | - 短期效果(2周):改善症状与胃功能 |
持续性 | 部分研究显示疗效可持续至治疗后8-12周 |
微信公众号: 回映电子
HUIYING
回映产品
本产品采用经皮耳迷走神经刺激(taVNS)技术,采用经皮耳迷走神经刺激(taVNS)技术,通过非侵入性电刺激耳甲腔及耳甲艇的迷走神经分支,精准调控耳部迷走神经分支(耳甲腔CO10、耳甲艇CO15等穴位);具有多种刺激模式、信号调节范围大,直接作用于神经生理机制,可适用于睡眠障碍、焦虑症状、乏力、食欲减退、偏头痛、以及癫痫等多种疾病的辅助治疗。
基本参数
刺激强度:0 - 30mA;
刺激频率:1 - 200Hz;
刺激脉宽:100 - 1000us;
刺激维持ON状态:1 - 500s;
刺激间歇OFF状态:1 - 500s;
淡入淡出时间:0 - 10s.
-
医疗电子
+关注
关注
30文章
1425浏览量
91969 -
电刺激装置
+关注
关注
0文章
42浏览量
5730
发布评论请先 登录
经颅电刺激系列之迷走神经刺激(VNS)

taVNS经耳迷走神经电刺激适应症之改善慢性/原发性失眠

taVNS经耳迷走神经电刺激适应症之改善功能性消化不良

taVNS经耳迷走神经电刺激适应症之缓解偏头痛

taVNS经耳迷走神经电刺激适应症之改善抑郁、焦虑情绪

功能性电刺激(FES)—神经假肢

闭环经皮耳廓迷走神经刺激(taVNS)与 EEG、HRV 的技术融合

迷走神经电刺激适应症之taVNS缓解认知障碍

呼吸门控闭环经耳迷走神经电刺激taVNS如何缓解抑郁

Aigtek宽带功率放大器赋能无创迷走神经无线电刺激新策略

超微型化闭环迷走神经刺激系统(CLV)如何实现(中风)






 迷走神经电刺激适应症之taVNS改善功能性消化不良
迷走神经电刺激适应症之taVNS改善功能性消化不良











评论