经皮脊髓电刺激(transcutaneous spinal cord stimulation, tSCS)
经皮脊髓电刺激是一种通过皮肤表面电极向脊髓背根传递低频脉冲电流、实现神经调控的非侵入性技术。
其核心原理是利用电流对脊髓背根神经纤维的兴奋性作用,激活脊髓神经回路并重塑神经可塑性,从而改善脊髓损伤(SCI)后的运动及自主神经功能。
经皮脊髓电刺激(tSCS)起源于19世纪,1982年Marsden证实经皮电刺激可兴奋脊髓神经,2007年Minassian发现胸腰段后根刺激改变下肢反射,为其在脊髓损伤(SCI)康复应用奠基。
相较侵入性硬膜外刺激(eSCS),tSCS因无需手术、安全性高、并发症少更具临床潜力,早期聚焦激活脊髓中央模式发生器诱导节律性运动。
2011年Harkema的植入式刺激研究推动了非侵入性tSCS研发。
近十年研究显示,tSCS联合训练可改善SCI患者下肢站立步行、上肢功能,甚至使完全性瘫痪患者恢复功能,推动神经康复从 “代偿” 向 “恢复” 转变。
HUIYING
tSCS的原理机制
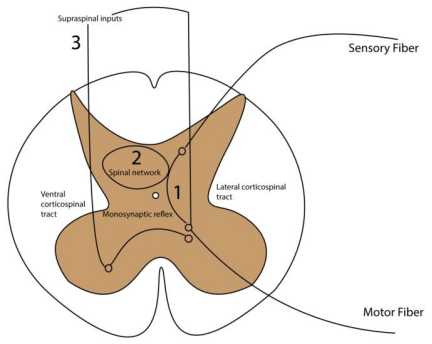
脊髓刺激的作用机制
背根传入纤维激活与单突触反射增强
tSCS通过皮肤电极激活脊髓背根大直径有髓传入纤维(如Ia纤维),其高兴奋性使其优先被激活并传递本体感觉信息。
Ia纤维经单突触连接兴奋脊髓前角运动神经元,增强单突触反射。
动物实验证实切断本体感觉传入后tSCS疗效减弱,人类研究中tSCS可诱发后根-肌肉反射(PRM反射),证实背根传入介导的神经通路。
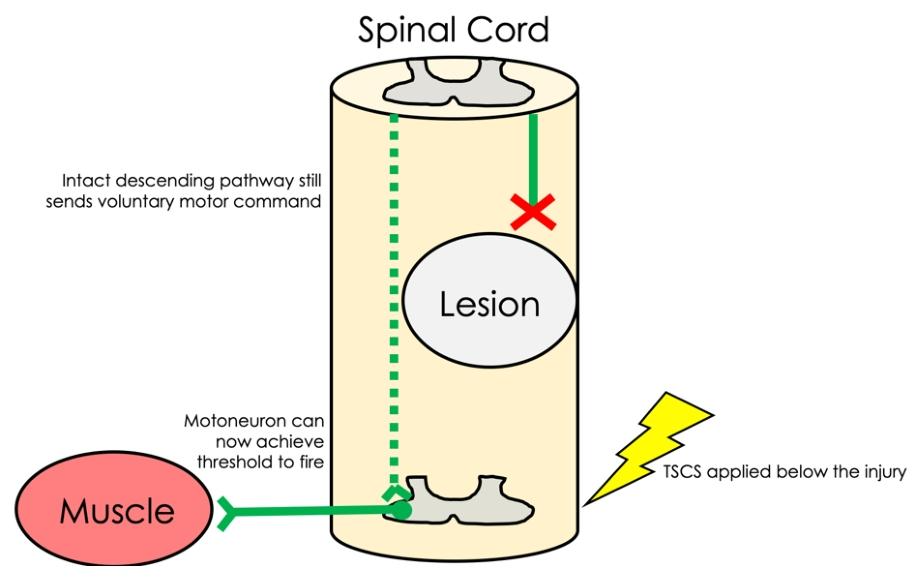
tSCS使运动神经元基线兴奋性增加
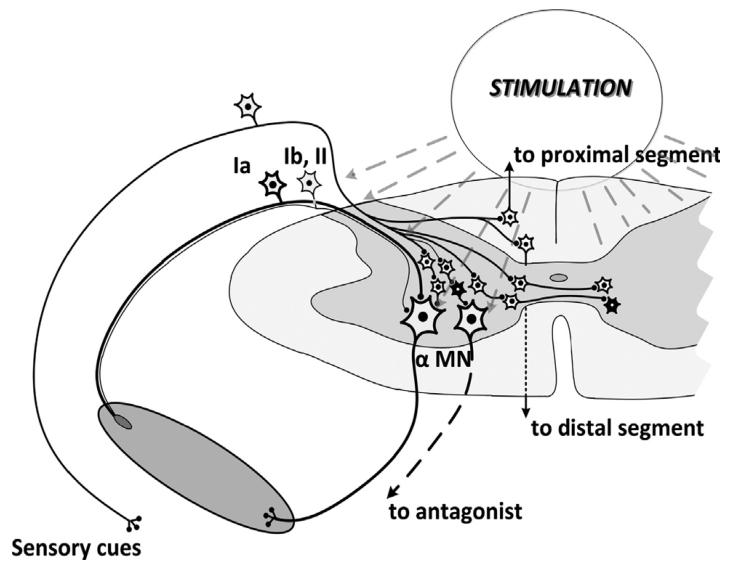
tSCS激活Ia、Ib、II 类传入纤维和 α 运动神经元
脊髓神经网络重组与中央模式发生器激活
脊髓神经网络具可塑性,tSCS通过持续刺激重塑连接,激活腰髓中央模式发生器(CPGs)。CPGs神经元分布于腰髓中央管附近,其激活可诱导屈肌/伸肌节律性活动,促进步行恢复。动物实验显示tSCS联合训练重组脊髓固有通路,人类研究中胸腰段刺激改善SCI患者躯干稳定性,提示其作用不限于下肢。
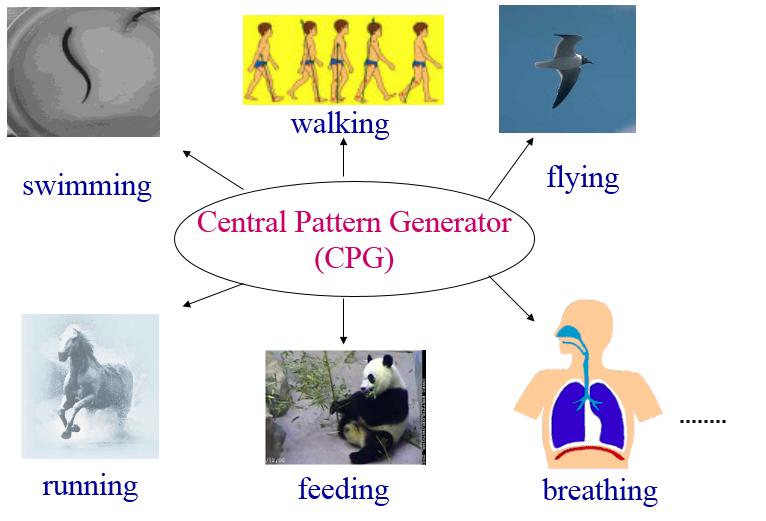
CPG介导的运动控制机制
上位中枢输入增强与神经可塑性促进
tSCS提高脊髓运动神经元兴奋性,增强对残留上位中枢输入(如皮质脊髓束)的反应性,使微弱信号重获驱动肌肉能力。猴子实验中颈部刺激增强上肢运动神经元敏感性,人类研究显示颈腰联合刺激增强皮质脊髓通路激活。持续刺激可能通过长时程增强(LTP)诱导神经可塑性,联合训练疗效可维持3-6个月。
自主神经功能调节机制
tSCS通过激活脊髓自主神经中枢调节交感-副交感平衡。动物模型中其靶向膀胱、盆底肌神经通路,改善逼尿肌功能;临床研究显示颈髓刺激可调节交感神经输出,改善SCI患者直立性低血压,部分患者出现出汗及体温调节恢复。
HUIYING
适应症与具体治疗参数
核心适应症
1.脊髓损伤(SCI)患者
完全性损伤(AIS A):研究显示,tSCS联合训练可使部分AIS A患者从完全瘫痪提升至C/D级,恢复下肢站立能力。
不完全性损伤(AIS B-D):对AIS B-D患者,tSCS可改善下肢步行、上肢抓握等功能,尤其对运动功能严重受损者(如AIS B)有效。
2.运动功能障碍
下肢功能恢复:激活脊髓中央模式发生器(CPGs),诱导节律性运动,改善站立、步行能力。
上肢功能恢复:针对颈髓SCI四肢瘫患者,提升握力及精细运动(如抓握),增强皮质脊髓通路兴奋性。
3.自主神经功能障碍
膀胱控制:调节逼尿肌功能,减少过度活动,增加膀胱容量。
心血管调节:改善直立性低血压,降低自主神经反射异常发生率。
刺激电极位置与对应病症
颈椎刺激:阴极置于C3-C4和C6-C7棘突中线,阳极置于双侧髂嵴或锁骨远端。改善手臂和手部功能障碍(如瘫痪、无力、精细动作丧失)。
胸腰椎刺激:阴极置于T11-L1棘突中线,阳极置于双侧髂嵴或脐周。改善姿势、平衡,并可能调节心血管和呼吸功能。
骶段刺激:阴极置于Co1(尾骨),阳极置于髂嵴。骶段刺激:阴极置于Co1(尾骨),阳极置于髂嵴。恢复腿部运动功能(站立、行走)和改善盆腔器官功能(膀胱、肠道、性功能)。
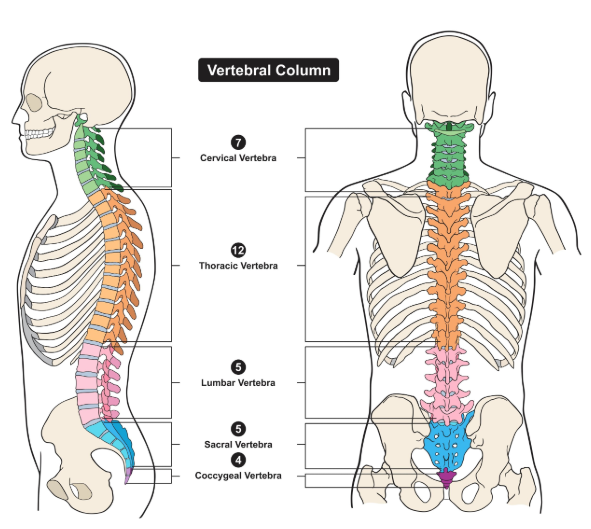
电极放置位置示意图
刺激波形与参数
波形:双相脉冲(常用,1ms脉宽+ 10kHz载波,减少损伤),单相脉冲少用。
频率/脉宽:运动功能30-50Hz、自主神经0.5-1Hz;脉宽150-1000μs(常用210-500μs)。
强度:上肢40-120mA、下肢60-180mA,以诱发PRM反射或轻微收缩且无痛为阈值。
HUIYING
临床实验研究验证
下肢运动功能恢复研究
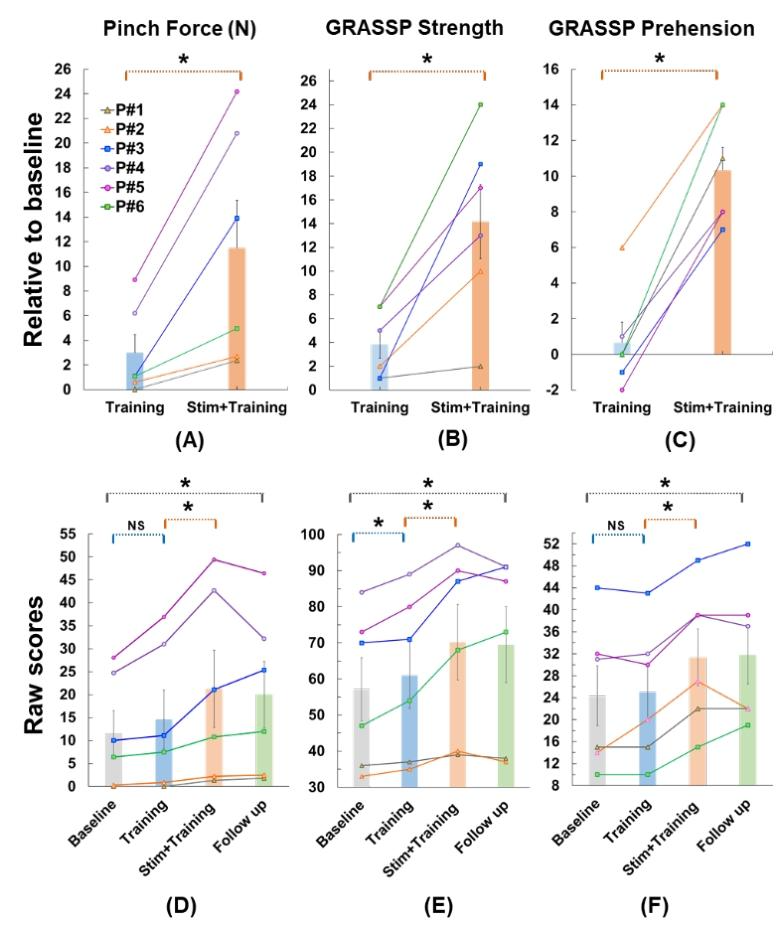
1.研究方法
多项研究采用tSCS联合活动- based训练的方案,干预对象为慢性SCI患者(损伤时间≥1年),损伤程度包括运动完全性(AIS A)和不完全性(AIS B-D)。刺激部位多选择腰髓对应皮肤区域(T11-L1),电极配置为阴极置于棘突中线,阳极置于双侧髂嵴。刺激参数通常为:频率30-40 Hz,脉冲宽度210-1000 μs,强度从亚运动阈值逐步增加至诱发轻微肌肉收缩但不引起疼痛。训练方案包括减重步行、站立平衡训练等,每周3-5次,每次60-120分钟,持续4-12周。
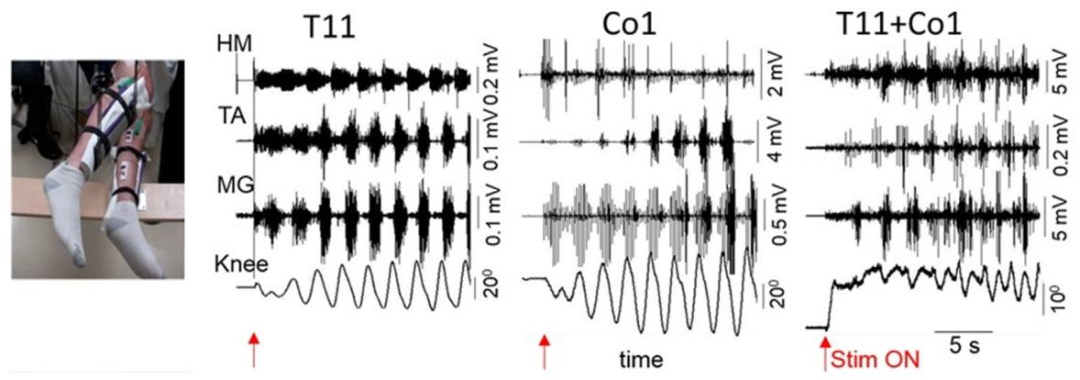
电极配置和脊髓电刺激诱导的肌电图
2.研究结果
AIS A患者8周后8例升为C级、2例D级,下肢肌力增强,部分可辅助站立;5-50Hz刺激分别诱发下肢伸展/屈伸运动,8例AIS A-B患者出现类似步行肌电的节律性活动。
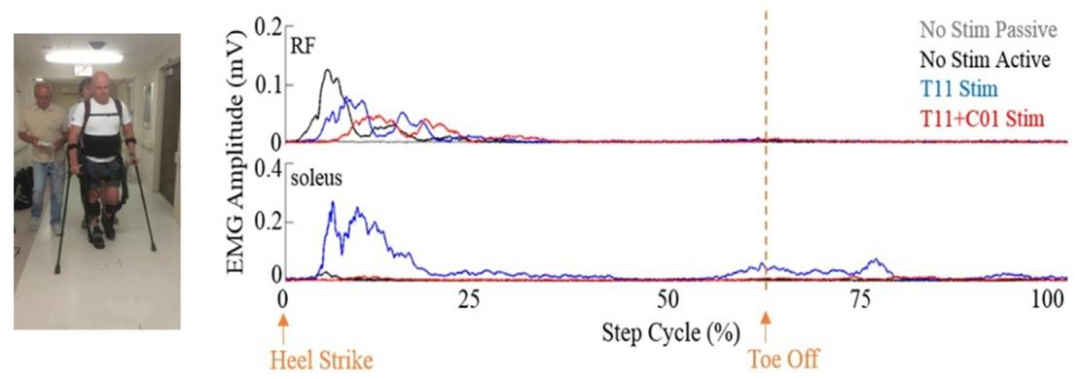
有/ 无 刺激时步幅周期内的平均肌电活动
3.结论
tSCS联合任务特异性训练可有效促进SCI患者的下肢运动功能恢复,尤其在站立平衡、步态协调和自主运动控制方面效果显著。即使在运动完全性损伤患者中,tSCS也能通过激活脊髓残留回路和促进神经可塑性,实现功能重建。
上肢功能恢复研究
1.研究方法
针对颈髓SCI导致的四肢瘫患者,tSCS多作用于颈椎区域(C3-C4、C6-C7),阴极置于棘突中线,阳极置于髂嵴或锁骨远端。刺激参数为:频率30 Hz,载波频率10 kHz,脉冲宽度1000 μs,强度根据患者耐受度调整(通常40-120 mA)。训练内容包括抓握、捏取、上肢伸展等功能任务,结合tSCS同步进行,每周3次,每次2小时,持续4-8周。
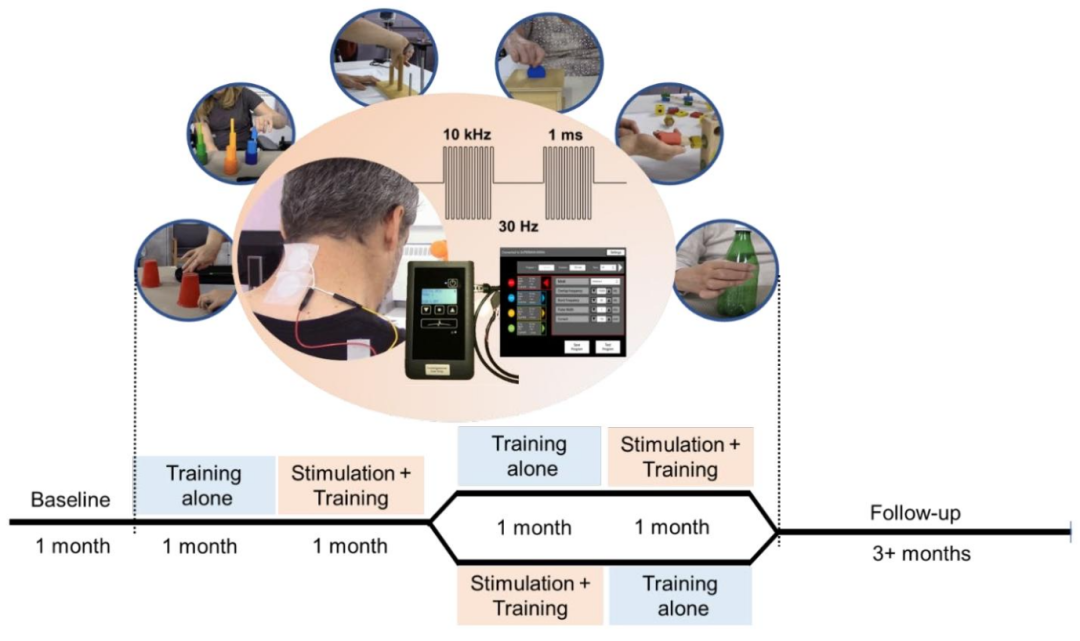
研究设计
2.研究结果
握力提高225%-325%,ARAT评分增加,部分患者恢复精细运动;fNIRS显示颈部刺激增强初级运动/体感皮层激活及半球间连接。
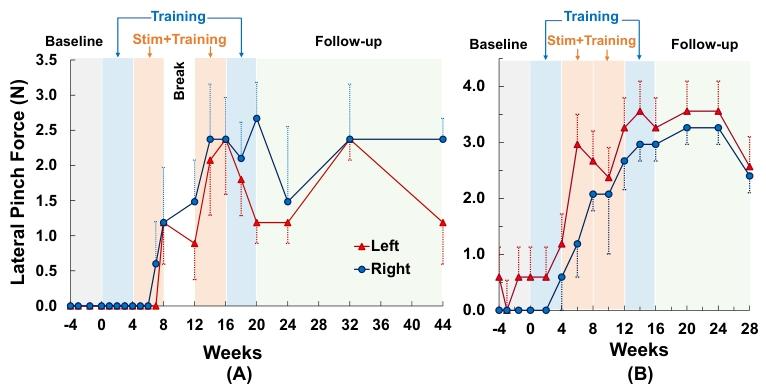
经皮脊髓刺激联合强化训练使两名瘫痪参与者重新获得手指运动能力和捏力
刺激改善的手部功能可持续数月
3.结论
颈部tSCS对SCI后的上肢功能恢复具有积极作用,可改善抓握力量、精细运动控制和日常生活能力。其机制可能涉及增强皮质脊髓通路兴奋性和促进大脑半球间的功能重组。
自主神经功能恢复研究
1.研究方法
针对膀胱、肠道功能障碍及心血管调节异常的SCI患者,tSCS多作用于胸腰段(T11-L1)或骶段(Co1),采用单极或双极刺激。膀胱功能研究中,刺激参数为:频率30 Hz,载波10 kHz,强度亚运动阈值,每次30分钟,每日1次,持续2-4周。心血管调节研究中,刺激频率多为0.5-30 Hz,强度根据血压反应调整。
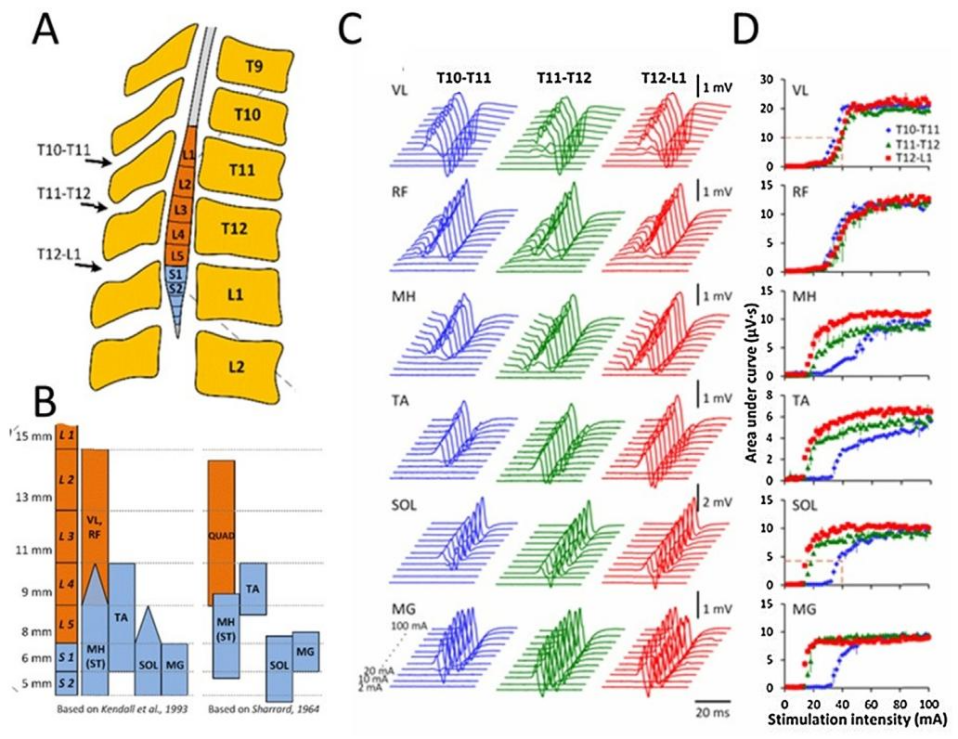
A经皮脊髓电刺激在腰骶膨大处的大致位置重建图B.运动神经池刺激后的时间窗。C. 经皮脊髓电刺激时的诱发电位D. 脊髓刺激各部位右侧肌肉的募集曲线
2.研究结果
膀胱过度活动减少,容量增加;直立性低血压改善(收缩压110-120mmHg),自主神经反射异常发生率降低。
3.结论
tSCS对SCI后的自主神经功能障碍具有潜在治疗价值,可改善膀胱控制、心血管调节等,提高患者生活质量。其机制可能与激活脊髓自主神经中枢和调节交感-副交感神经平衡有关。
总结与展望
经皮脊髓电刺激tSCS作为一种非侵入性神经调控技术,已在SCI康复中展现出显著潜力。其核心机制包括激活背根传入纤维、重组脊髓神经网络、增强上位中枢输入及调节自主神经功能。临床研究证实,tSCS联合任务特异性训练可有效改善SCI患者的下肢站立步行、上肢抓握控制及膀胱心血管功能,甚至在完全性瘫痪患者中实现功能重建。
-
电流
+关注
关注
40文章
7196浏览量
140382 -
医疗电子
+关注
关注
30文章
1425浏览量
91990 -
电刺激装置
+关注
关注
0文章
42浏览量
5731
发布评论请先 登录





 非侵入性经皮脊髓电刺激(tSCS)的神经机制与脊髓损伤康复临床应用
非侵入性经皮脊髓电刺激(tSCS)的神经机制与脊髓损伤康复临床应用














评论